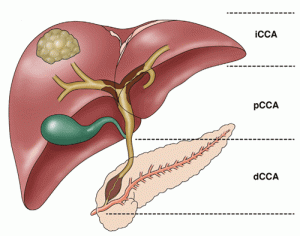
Incyte ha annunciato che il Comitato per i medicinali per uso umano (CHMP) dell’Agenzia europea per i medicinali (EMA) ha emesso un’opinione positiva, raccomandando l’autorizzazione all’immissione in commercio condizionale di pemigatinib per il trattamento di adulti con colangiocarcinoma non resecabile localmente avanzato o metastatico con fusione o riarrangiamento del recettore 2 del fattore di crescita dei fibroblasti (FGFR2), recidivante o refrattario dopo almeno una prima linea di terapia sistemica. Se approvato, pemigatinib sarà la prima terapia mirata nell’Unione europea per questa indicazione.
Cerca articoli
Articoli recenti
- Airway Therapeutics lancerà un trial clinico di fase 3 su zelpultide alfa per i neonati pretermine a rischio di displasia broncopolmonare
- Dal 5 al 7 novembre a Roma Welfair 2024: la fiera per progettare il futuro del Servizio sanitario nazionale
- Ecco il primo avatar fotorealistico per persone affette dalla malattia di Alzheimer
- Indagine Fòrema-UniPd su gender, linguaggio e molestie nelle aziende
- Il Policlinico Federico II di Napoli centro di riferimento regionale per il trattamento con denervazione renale dei pazienti ipertesi